
产品货号:
CZ101
中文名称:
His标签蛋白纯化试剂盒(磁珠法)
英文名称:
BalBeads His-tag Protein Purification Kit
产品规格:
10T
发货周期:
1~3天
产品价格:
询价
本产品是钴离子螯合磁珠为主要成分,还包含磁珠使用过程中所需的主要缓冲液和试剂组分。按照本说明书的操作流程,部分浓缩型缓冲液经过简单稀释、溶解,即可直接用于磁珠法组氨酸标签蛋白纯化和磁珠再生等操作,为用户解决繁杂、费时费力的缓冲液配制问题,轻松实现快速小量蛋白纯化及高通量纯化筛选。用户也可以参考本说明书,根据各自实验的不同需求,自行配制各类缓冲液和试剂组分。
钴离子螯合磁珠具有超顺磁性,是专为高效、快速纯化组氨酸标签蛋白而设计的一种新型功能化材料,用于组氨酸标签蛋白纯化操作时,无需对粗蛋白样品进行高速离心,也不需要过滤操作;无需控制流速,更不需要昂贵的层析设备,通过磁性分离快速实现固-液、液-液分离,操作过程简单。适用于纯化细菌、酵母、哺乳动物细胞等分泌或胞内表达的可溶性组氨酸标签蛋白,也可用于变性蛋白的纯化。

| 序号 | 组分 | 内容 | 规格 |
| ① | His-tag蛋白纯化磁珠(钴离子) | 10% v/v磁珠悬液20%醇溶液保存 | 5mL |
| ② | 10×Phosphate Buffer | 200mM Sodium Phosphate,pH7.4 | 50mL |
| ③ | 10×Imidazole Buffer | 200mM Sodium Phosphate,5M Imidazole,pH7.4 | 50mL |
| ④ | NaCl | 20×1.46g | |
| ⑤ | Stripping Buffer | 50mM Tris-HCl,500mM NaCl,100mM EDTA,pH7.4 | 30mL |
| ⑥ | Beads Washing Buffer | 0.5M NaOH,2M NaCl | 15mL |
| ⑦ | Recharge Buffer | 100mM CoCl2 | 15mL |
| ⑧ | Storage Buffer(用户自备) | 20%乙醇 | 50mL |
保存:2~8℃,有效期2年。

- 首次使用本产品前,请务必详细阅读本用户手册;
- 磁珠使用和保存过程中应避免冷冻、干燥和高速离心等操作;
- 在使用本产品前,请务必充分振荡使磁珠保持均匀的悬浮状态;
- 请选用质量好的移液器吸头和离心管,以免磁珠贴壁或混合过程发生渗漏引起磁珠的损耗;
- 磁珠与溶液混合过程中,如果溶液粘稠无法通过翻转离心管重悬磁珠,可采用移液器反复吹吸或短时漩涡混合使磁珠充分重悬;
- 用户可根据实际需要保留经磁性分离移去的上清液,进行取样检测,以便分析纯化过程和优化蛋白纯化流程;
- 本产品可以重复使用,当纯化性能降低时,建议进行再生处理;
- 使用过的磁珠重复使用时,建议纯化同种蛋白,纯化不同种类的蛋白时,建议使用新的磁珠;
- 本产品需与磁性分离器配套使用;
- 本产品仅供研究使用。

一般情况下,磁珠的使用量是由用户根据目标蛋白产量和磁珠载量信息计算获得,例如通过预实验估算其目标蛋白产量为10~15mg,BalBeads钴离子磁珠与目标蛋白结合量为2~3mg/mL,用户需要取5mL磁珠悬液用于目标蛋白的纯化。缓冲液的使用量根据磁珠使用量进行相应调整。
- 缓冲液的准备
目标蛋白与金属离子螯合磁珠的结合性能将直接影响目标蛋白的纯化效率,各种缓冲液也将在一定程度上影响目标蛋白的回收率和纯度。因此,在较大规模蛋白纯化之前,用户应自行设计实验,筛选出适合目标蛋白的缓冲液,包括结合缓冲液(Binding Buffer),洗涤缓冲液(Washing Buffer)和洗脱缓冲液(Elution Buffer)。
以下提供的缓冲液体系适用于多数组氨酸标签蛋白的纯化,供用户参考。- Binding Buffer:20mM Sodium Phosphate,500mM NaCl,5~50mM Imidazole,pH7.4。
- Washing Buffer:20mM Sodium Phosphate,500mM NaCl,50~100mM Imidazole,pH7.4。
- Elution Buffer:20mM Sodium Phosphate,500mM NaCl,500mM Imidazole,pH7.4。
本产品为用户预制了10×Phosphate Buffer和10×Imidazole Buffer以及相关的盐,可以直接加入ddH2O配制成1×Phosphate Buffer和1×Imidazole Buffer。再以此为基础,配制适合目标蛋白纯化操作所需的Binding Buffer、Washing Buffer和Elution Buffer。
表1.1×Phosphate Buffer和1×Imidazole Buffer的配制方法名称 成分 体积 配制方法 1×Phosphate Buffer 20mM Sodium Phosphate,500mM NaCl,pH7.4 50mL 5mL 10×Phosphate Buffer(②)+ 1管NaCl(④) +40mL ddH2O,溶解后定容至50mL。 1×Imidazole Buffer 20mM Sodium Phosphate,500mM NaCl,500mM Imidazole,pH7.4 50mL 5mL 10×Imidazole Buffer(③)+ 1管NaCl(④)+40mL ddH2O,溶解后定容至50mL。
表2.含不同浓度Imidazole溶液的配制Imidazole终浓度(mM) 1×Phosphate Buffer(mL) 1×Imidazole Buffer(mL) 缓冲液体积(mL) 5 49.5 0.5 50 10 49 1 50 20 48 2 50 40 46 4 50 80 42 8 50 100 40 10 50 200 30 20 50
用户可以根据实际用量按右表比例配制含不同浓度Imidazole的Binding Buffer和Washing Buffer,1×Imidazole Buffer可作为Elution Buffer直接使用。 - Binding Buffer:20mM Sodium Phosphate,500mM NaCl,5~50mM Imidazole,pH7.4。
- 样品处理
本操作说明书提供以下三种样品处理方法:- 大肠杆菌、酵母等细胞内表达蛋白:按每克细胞加入5~10mL Binding Buffer,加入蛋白酶抑制剂(如终浓度为1mM的PMSF),重悬细胞,冰浴超声裂解细胞,即为粗蛋白样品。如果样品过于粘稠,可根据需要在粗样品中加入适量核酸酶,在冰上放置30min,以降解核酸。另外,用户也可以根据实际需要对蛋白样品进行离心操作。
- 胞外表达蛋白:取胞外表达上清,用等量Binding Buffer稀释,即为粗蛋白样品。
- 动物细胞胞内表达蛋白:取适量动物细胞,用适量PBS(自备)洗涤1次,弃上清,用适量含1%(v/v) Triton X-100或1%(v/v) NP-40的Binding Buffer重悬,加入蛋白酶抑制剂(如终浓度为1mM的PMSF),置于冰上10min,即为粗蛋白样品。
- 大肠杆菌、酵母等细胞内表达蛋白:按每克细胞加入5~10mL Binding Buffer,加入蛋白酶抑制剂(如终浓度为1mM的PMSF),重悬细胞,冰浴超声裂解细胞,即为粗蛋白样品。如果样品过于粘稠,可根据需要在粗样品中加入适量核酸酶,在冰上放置30min,以降解核酸。另外,用户也可以根据实际需要对蛋白样品进行离心操作。
- 磁珠预处理
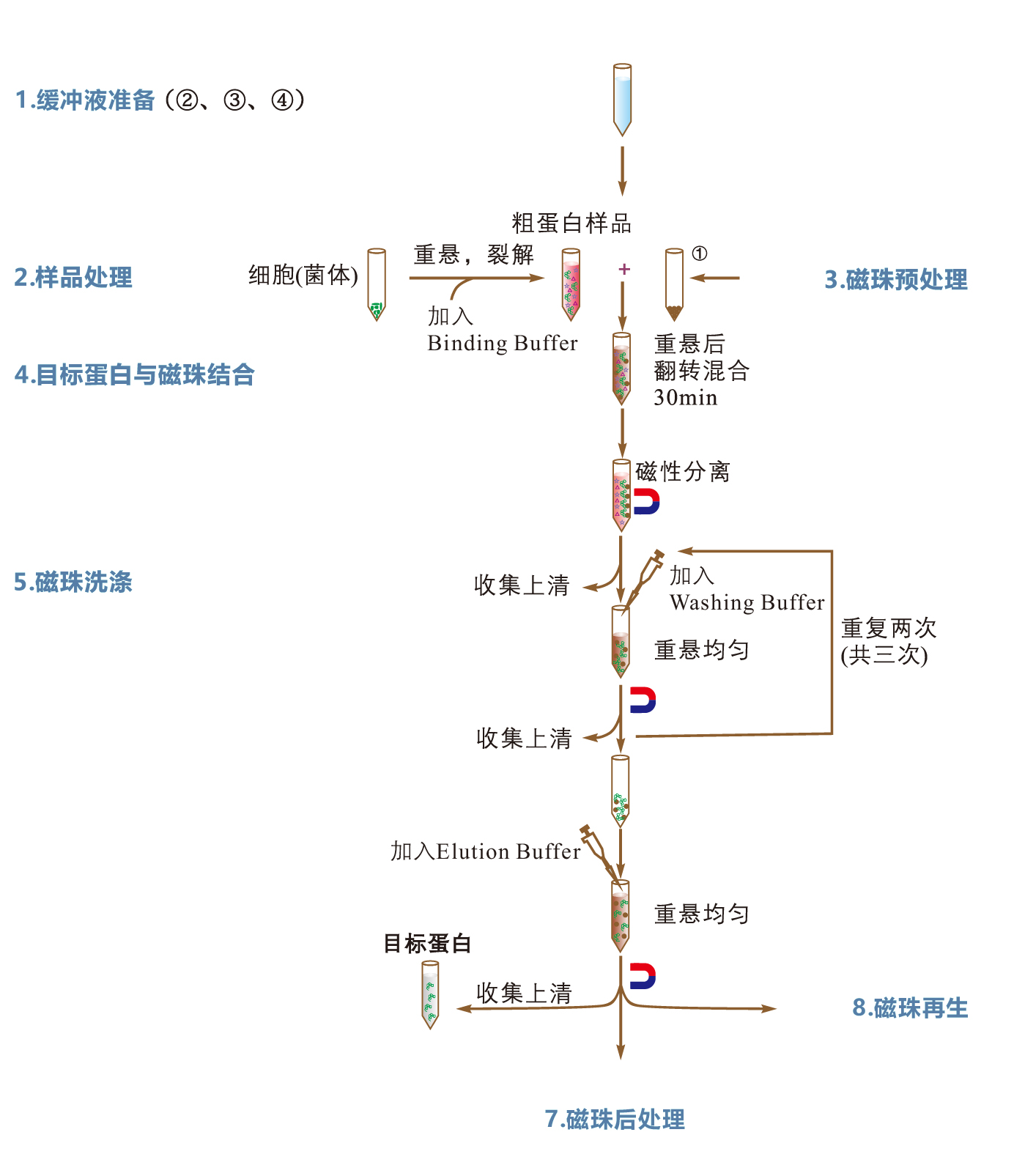
以纯化大肠杆菌表达的组氨酸标签蛋白为例说明蛋白纯化操作。500mL发酵液收获2g湿重的菌体,通过预实验估算其目标蛋白产量为10~20mg,用户需要取5mL磁珠悬液用于目标蛋白的纯化。- 将金属离子螯合磁珠(①)置于漩涡混匀器上充分混匀,用移液器取5mL磁珠悬液于15mL离心管中,进行磁性分离,弃上清液,从磁性分离器上取下离心管。
注:将离心管放置于磁性分离器上,使磁珠被吸附在管壁至溶液澄清;在磁性分离过程中,为减少磁珠在使用过程中的损耗,待溶液变澄清后,盖紧离心管盖子,保持离心管仍在磁性分离器上,手持磁性分离器与离心管上下翻转数次,使澄清的溶液涮洗离心管盖上残留的磁珠,静置片刻,使溶液重新变澄清;该操作描述以下省略。 - 加入5mL Binding Buffer到上述装有磁珠的离心管中,上下翻转离心管数次,使磁珠重新悬浮,进行磁性分离,移去上清液。重复洗涤2次。
- 将金属离子螯合磁珠(①)置于漩涡混匀器上充分混匀,用移液器取5mL磁珠悬液于15mL离心管中,进行磁性分离,弃上清液,从磁性分离器上取下离心管。
- 目标蛋白与磁珠结合
- 用10mL Binding Buffer悬浮2g湿重的菌体,进行破碎和裂解之后,即为目标粗蛋白样品,加入到装有预处理磁珠的离心管中,将离心管置于漩涡混匀器振荡15s。
- 将离心管置于旋转混合仪上,室温旋转混合20~30min(如果需要,可以在2~8℃的低温环境下,旋转混合1h,防止目标蛋白降解)。
- 将离心管置于磁性分离器上进行磁性分离,移出上清液至新的离心管中以备后续检测,从磁性分离器上取下离心管进行后续洗涤步骤。
- 用10mL Binding Buffer悬浮2g湿重的菌体,进行破碎和裂解之后,即为目标粗蛋白样品,加入到装有预处理磁珠的离心管中,将离心管置于漩涡混匀器振荡15s。
- 磁珠洗涤
- 加入10mL Washing Buffer到装有磁珠的离心管中,轻轻翻转离心管数次,使磁珠重新悬浮,磁性分离,移出清洗液到新的离心管中,以备取样检测。重复此述步骤1次。
- 加入10mL Washing Buffer到装有磁珠的离心管,使磁珠重新悬浮,将磁珠悬液转移到新的离心管(避免原离心管壁上非特异性吸附蛋白污染目标蛋白),磁性分离,移出上清液到清洗液收集管。
- 加入10mL Washing Buffer到装有磁珠的离心管中,轻轻翻转离心管数次,使磁珠重新悬浮,磁性分离,移出清洗液到新的离心管中,以备取样检测。重复此述步骤1次。
- 目标蛋白洗脱
- 用户可根据需要改变洗脱体积调整目标蛋白浓度,加入2~10mL Elution Buffer,轻轻翻转离心管数次,使磁珠悬浮,磁性分离,收集洗脱液到新的离心管中,即为纯化的目标蛋白样品。
- 如果需要,可以重复上述步骤1次,收集样品到新的离心管中,以检测目标蛋白是否洗脱完全。
- 通过SDS-PAGE或Western blotting检测目标蛋白。如果需要测定蛋白质浓度,可以采用Elution Buffer调零再进行测定,或者采用透析、超滤等方法去除Imidazole后再进行浓度测定。
- 用户可根据需要改变洗脱体积调整目标蛋白浓度,加入2~10mL Elution Buffer,轻轻翻转离心管数次,使磁珠悬浮,磁性分离,收集洗脱液到新的离心管中,即为纯化的目标蛋白样品。
- 磁珠后处理
- 在装有磁珠的离心管中加入5mL Elution Buffer,上下翻转离心管数次,使磁珠悬浮,磁性分离,去除上清液。
- 重复上述步骤2次。
- 在离心管中加入5mL ddH2O,上下翻转离心管数次,使磁珠悬浮,磁性分离,去除上清液。
- 上述步骤c重复2次。
- 加入Storage Buffer(⑧)到磁珠中使总体积为5mL,保存于2~30℃(长期保存,置于2~8℃),可用于下一次同种蛋白的纯化。
- 在装有磁珠的离心管中加入5mL Elution Buffer,上下翻转离心管数次,使磁珠悬浮,磁性分离,去除上清液。
- 磁珠再生
磁珠连续使用3次或以上,其结合目标蛋白的能力可能会明显降低,建议进行磁珠再生处理。
以5mL 10%(v/v)磁珠悬液为例,详细说明磁珠再生操作。- 将磁珠悬液进行磁性分离,去除上清液,从磁性分离器上取下离心管,在离心管中加入5mL ddH2O,上下翻转离心管数次,使磁珠重新悬浮,磁性分离,去除上清液。
- 加入5mL Stripping Buffer(⑤),上下翻转离心管数次,使磁珠重新悬浮,室温旋转混合5min,磁性分离,去除上清液。重复此步骤1次。
- 加入5mL ddH2O,上下翻转离心管数次,使磁珠重新悬浮,磁性分离,去除上清液,重复此步骤2次。
- 碱处理(可选步骤):加入5mL Beads Washing Buffer(⑥),上下翻转离心管数次,使磁珠重新悬浮,室温旋转混合5min,磁性分离,去除上清液。加入5mL ddH2O,上下翻转离心管数次,使磁珠重新悬浮,磁性分离,去除上清液。重复ddH2O洗涤步骤3~5次,至洗涤液呈中性为止。
- 加入5mL Recharge Buffer(⑦),上下翻转离心管数次,使磁珠重新悬浮,室温旋转混合20min,磁性分离,去除上清液。(Recharge Buffer:100mM CoCl2,该化学试剂有一定毒性,可能造成过敏反应,使用时务必注意!)
- 加入5mL ddH2O,上下翻转离心管数次,使磁珠重新悬浮,磁性分离,去除上清液。重复此步骤4次。
- 加入Storage Buffer (⑧)到磁珠中使总体积为5mL,保存于2~8℃。
- 将磁珠悬液进行磁性分离,去除上清液,从磁性分离器上取下离心管,在离心管中加入5mL ddH2O,上下翻转离心管数次,使磁珠重新悬浮,磁性分离,去除上清液。

一、蛋白纯化流程的优化
以上操作流程适用于大部分组氨酸标签蛋白的纯化,根据目标蛋白与金属离子螯合磁珠的结合性能不同,用户可以从以下几个方面对纯化流程进行优化,以提高目标蛋白的回收率和纯度。
- 样品溶液和Binding Buffer中的Imidazole浓度,以及其它添加试剂的成分和浓度;
- 样品处理的方式、样品溶液体积、浓度等;
- 纯化使用的磁珠量;
- 样品溶液与磁珠孵育的温度和时间;
- 洗涤磁珠的时间和次数;
- 目标蛋白洗脱时的Imidazole浓度,洗脱时间、体积和次数等。
- 提高目标蛋白回收率的参考方法:
- 降低样品溶液和Binding Buffer中的Imidazole浓度;
- 样品溶液和其它缓冲液中添加表面活性剂等物质;
- 添加合适的蛋白酶抑制剂,防止目标蛋白降解;
- 增加磁珠用量;
- 延长蛋白与磁珠孵育的时间;
- 延长洗脱目标蛋白的时间或增加洗脱次数。
- 降低样品溶液和Binding Buffer中的Imidazole浓度;
- 提高目标蛋白纯度的参考方法:
- 提高样品溶液和Binding Buffer中Imidazole、NaCl的浓度;
- 样品和缓冲液中添加表面活性剂等物质;
- 添加合适的蛋白酶抑制剂,防止目标蛋白降解;
- 延长洗涤的时间,增加洗涤次数;
- 采用梯度Imidazole浓度洗脱目标蛋白。
- 提高样品溶液和Binding Buffer中Imidazole、NaCl的浓度;
二、磁珠的耐受性
| 种类 | 名称 | 可耐受浓度 | 备注 |
| 还原剂 | DTE | 5mM | 在使用还原剂之前,请先用无还原剂的溶液洗涤磁珠。应避免长时间使用含有还原剂的溶液处理磁珠。 |
| DTT | 5mM | ||
| β-mercaptoethanol | 20mM | ||
| TCEP | 5mM | ||
| Reduced Glutathione | 10mM | ||
| 变性剂 | Urea | 8M | |
| Guanidine Hydrochlride | 6M | ||
| 表面活性剂 | Triton X-100 | 2% | |
| Tween 20 | 2% | ||
| NP-40 | 2% | ||
| Cholate | 2% | ||
| CHAPS | 1% | ||
| 缓冲溶液 | Sodium Phosphate,pH7.4 | 50mM | |
| HEPES | 100mM | ||
| Tris-HCl,pH7.4 | 100mM | ||
| Tris-Acetate,pH7.4 | 100mM | ||
| MOPS,pH7.4 | 100mM | ||
| Sodium Acetate,pH4.0 | 100mM | ||
| 其它溶液 | Imidazole | 500mM | |
| Ethanol | 20% | ||
| NaCl | 1.5M | ||
| Na2SO4 | 100mM | ||
| Glycerin | 50% | ||
| EDTA | 1mM | 限于在蛋白样品中添加,不可用于缓冲液。 | |
| Citrate | 60mM |
三、His标签蛋白纯化操作流程图
相关搜索:His标签蛋白纯化试剂盒(磁珠法),磁珠法His标签蛋白纯化试剂盒,His标签融合蛋白纯化试剂盒,BalBeads His-tag Protein Purification Kit



